■研究の概要:
私たちは、三次元の空間に生きています。炭素骨格で構築される有機分子の世界も同様であり、例えば薬品や農薬などの化合物がタンパクに作用する際には、化合物はタンパクが創り出す3次元空間(ポケット)によって認識されて結合することで、薬理作用が発現します。即ち、三次元の有機分子の形(分子骨格とも言います)の上に多彩な元素や官能基を適切に配置できれば、望む機能を獲得、調節することができるのです。
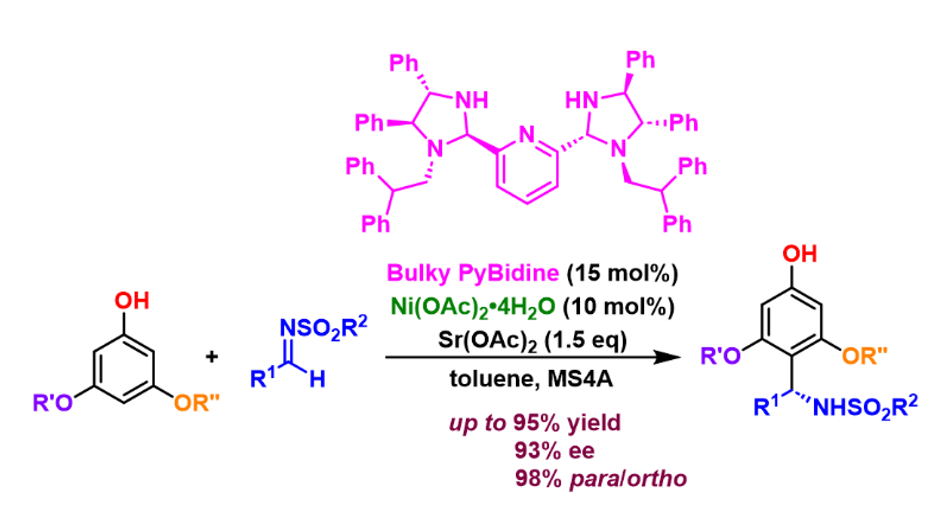
千葉大学大学院理学研究院の荒井孝義教授らの研究チームは、安価なフェノール類とイミン基質を用いた光学活性アミンを合成する反応において、これまでの合成方法では困難だった、フェノールのパラ位(フェノール性水酸基の反対側の位置)に選択的に反応させ、目的化合物を与える触媒の開発に成功しました。
幅広いイミン基質に適用可能な汎用性の高い、パラ位選択的な触媒的な不斉反応(右手と左手の関係にある鏡像異性体の一方を選択的に得る方法)として、世界初の成果になります。
今回の研究を応用することで、安価な医薬の開発が進むことが期待されます。
本研究成果は、学術誌ACS Catalysisにて2023年7月3日に公開されました。
■研究の背景:
医薬をはじめとする機能性分子を設計、開発する際、分子を構成するヘテロ原子(窒素や酸素)の配置はその機能に直結します。有機化学者は、いかに目標の分子骨格を効率的に構築し、ヘテロ官能基を目的化合物の適切な位置に導入するかという課題に取り組んできました。例えば、右手-左手の関係にある鏡像異性体を作り分ける触媒的不斉合成の重要性は、野依良治教授らのノーベル化学賞受賞や最近の有機触媒に対するノーベル化学賞の授与から広く知られるようになりました。 一方、2つの化合物を結合させる反応において、結合させる箇所を切り替えることができれば、新たな分子骨格の構築に繋がるため魅力的ではあるものの、より高いエネルギー差を克服しなければならない事が多く、難易度の高い課題でした。
今回の研究で取り上げたフェノールを基質とするイミンへのFriedel-Crafts反応注1)は炭素-炭素結合形成を経て天然物中に多く含まれるキラルベンジルアミンを人工的に得ることができるため、有用な反応です(図1)。一般に、電子密度の高いフェノール基質を用いてFriedel-Crafts反応を行うと、オルト位(フェノール性水酸基の隣の位置)もしくはパラ位(フェノール性水酸基の反対側の位置)において置換反応が進行しますが、多くの先行研究は、オルト位選択的な反応についてのものでした(図1-上の反応式)。これは、反応を促進するルイス酸触媒を利用した場合、六員環遷移状態注2)を経る反応として、触媒を合理的に設計できるためであり、実際、オルト位選択的なFriedel-Crafts反応では、片方の鏡像異性体が選択的に作り出される反応が数多く報告されています。
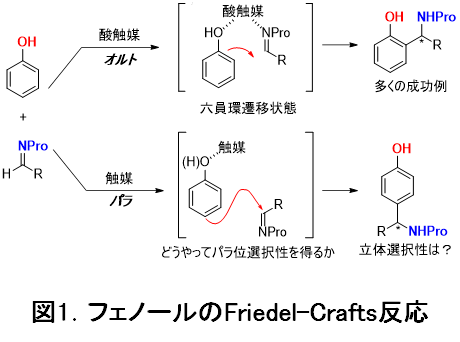
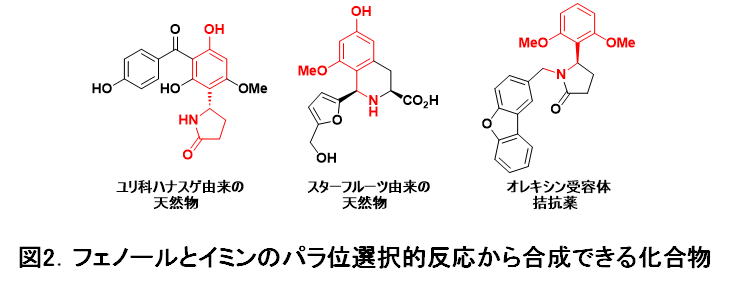
一方、パラ位での反応(図1-下の反応式)が達成できれば、図2に示すような生物活性物質の効率的な合成手法を提供できると期待されます。しかしながら、パラ位選択的な反応の報告は極めて少なく、また特殊な基質に限定されているなど、改善すべき課題が山積していました。
■研究の成果:
Friedel-Crafts型反応といえば、これまでルイス酸触媒を用い、求電子試薬(分子間の反応において他方の基質より電子を受け入れる反応性を示す化合物)のLUMO注3)のエネルギーを低下させることで達成されてきました(図1-上)。
どうすれば反応をオルト位選択的から、パラ位選択的に切り替えることができるのか。荒井教授らは、フェノールを基質にする場合、塩基性触媒を加えてフェノールのプロトンを引き抜いた「フェノキシド」にすることによっても反応を加速できるのではないかと考えました。フェノキシドはアニオンであるため、フェノールでいる時よりも電子密度が高まり、求核試薬(分子間反応において他方の基質に電子を与える反応性を示す化合物)としての反応性が高まります(HOMO注3)の活性化に相当)。この時、塩基性触媒によってオルト位を塞げば、パラ位選択性が得られると考えました(図3)。
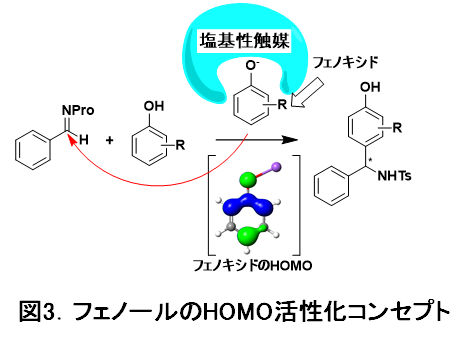
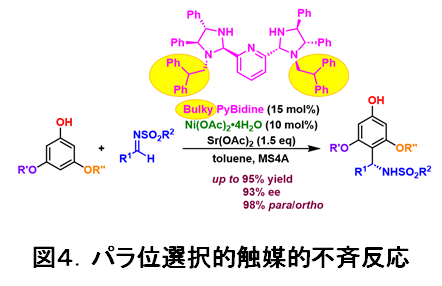
実際の触媒には、荒井研究室が独自に開発を進めてきた光学活性なビス(イミダゾリジン)ピリジン (PyBidine)配位子を用いることにしました(図4)。PyBidine配位子の構造や錯体触媒の塩基性を精査し、フェノールのオルト位をふさぐ大きな置換基(図4で、黄色で示した部位)を有する、嵩高いPyBidine配位子を新たに開発し、酢酸ニッケル錯体として触媒に用いることで、高いパラ位選択性と高不斉収率(一方の鏡像立体異性体が他の鏡像立体異性体よりも高い比率で生成されること)を実現しました。本反応は、広い範囲のフェノールとスルホニルイミンに適用可能です。
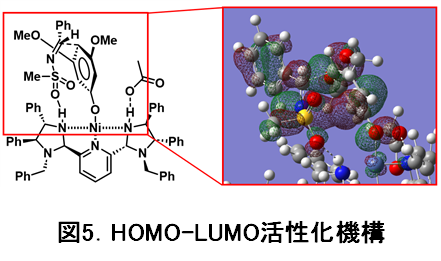
反応機能の詳細を理論計算によって検証し、コンセプト通り、ニッケル-フェノキシドの生成と、そのフェノキシドのオルト位が覆われることで、フェノールのパラ位で反応していることが明らかになりました(図5)。また、スルホニルイミン基質もPyBidine配位子が有する窒素上のプロトンによって活性化(LUMOの活性化に相当)していることもわかりました。即ち、HOMOとLUMOが同時に活性化されることによって、高いパラ位選択性と高い不斉収率(望ましい立体異性体の割合を示す指標)をもたらしていることが解明されました。
以上の研究により、荒井教授の研究チームは、これまで誰も成しえなかった、「フェノール類のパラ位選択的な触媒的不斉Friedel-Crafts反応」を一般的な合成手法として確立することに成功しました。
■今後の展望
本研究により、フェノールのパラ位選択的にアミノアルキル基を立体選択的に導入できるようになりました。多段階の反応を組み合わせて目的化合物を合成する有機化学を登山に例えるならば、今回のような位置選択性(特定の位置に選択的に反応が起こる性質)を切り替える反応開発は、新たな登山ルートを提供することになります。実際、今回の手法を用いて、図2に示したOrexin antagonist(オレキシン受容体拮抗薬。脳の覚醒を促進する神経伝達物質オレキシンの受容体を阻害することで、脳を睡眠状態へ移行させ睡眠障害を改善する化合物)を、従来法より簡便かつ効率的に合成できることも確認しています。引き続き、本手法を医薬合成に適用していく計画です。
HOMO-LUMO活性化機構は他の触媒開発にも応用できるコンセプトであり、その適用範囲はイミン基質に限定されるものではありません。構造多様性を有する分子の構築に応用し、重要な合成手法を開発していきたいと考えています。
■用語解説
注1)Friedel-Crafts反応:有機化学の反応の一つで、ベンゼンやトルエンなどの芳香族化合物に新しいアルキル基(炭素鎖)を導入する反応。具体的には、アルキルハライド(アルキル基にハロゲン原子が結合した化合物)やアシルハライド(アシル基にハロゲン原子が結合した化合物)などの反応剤を使って、芳香族化合物に新しいアルキル基などの求電子置換基を付けることができる。安価で入手容易な芳香族化合物を用いて、様々な求電子試薬を作用させることで、付加価値の高い化合物を得ることができる。
注2)六員環遷移状態:反応が進行する際、結合の組み換えが六角形に並んだ元素の間で起こる状態。歪みの少ない安定な六員環遷移状態は多くの反応を速やかに進行させるために有利とされる。
注3)HOMO, LUMO:電子に占有されている分子軌道のうち最もエネルギーの高い軌道を最高被占軌道(Highest Occupied Molecular Orbital: HOMO)、電子に占有されていない分子軌道のうち最もエネルギーの低い軌道を最低空軌道(Lowest Unoccupied Molecular Orbital: LUMO)という。化学反応は主に電子供与性の HOMO と電子受容性の LUMOの軌道の相互作用で理解される(福井謙一博士によって提唱されたフロンティア軌道理論)。
■研究プロジェクトについて
- 2022年度 内藤記念科学奨励金・研究助成
「HOMO活性化によるフェノール類のパラ位選択的Friedel-Crafts反応の開発」
■論文情報
タイトル:Asymmetric para-Selective aza-Friedel-Crafts Reaction of Phenols Catalyzed by Bulky PyBidine-Ni(OAc)2
著者:Ryoya Tajima, Takaaki Saito, Takayoshi Arai*
雑誌名:ACS Catalysis
DOI:https://doi.org/10.1021/acscatal.3c01961
■参考文献
・PyBidine配位子開発の最初の論文:
タイトル:Chiral Bis(imidazolidine)pyridine−Cu(OTf)2: Catalytic Asymmetric endo-Selective [3 + 2] Cycloaddition of Imino Esters with Nitroalkenes
著者:Arai, T.*; Mishiro, A.; Yokoyama, N.; Suzuki, K.; Sato, H.
雑誌名:J. Am. Chem. Soc.









