千葉大学国際高等研究基幹・大学院医学研究院の吉原正仁 准教授、カロリンスカ研究所(スウェーデン)、ヘルシンキ大学(フィンランド)からなる共同研究グループは、ヒトES細胞注1)よりもさらに受精卵に近い段階の細胞モデルの作製に取り組みました。その結果、ヒトES細胞にDUX4という遺伝子を一時的に発現させることで、8細胞期胚に似た細胞集団を誘導し、さらに、SLC34A2 (NaPi2b)注2)という細胞表面蛋白に対する抗体を用いて、これらの細胞を効率良く回収することに成功しました。
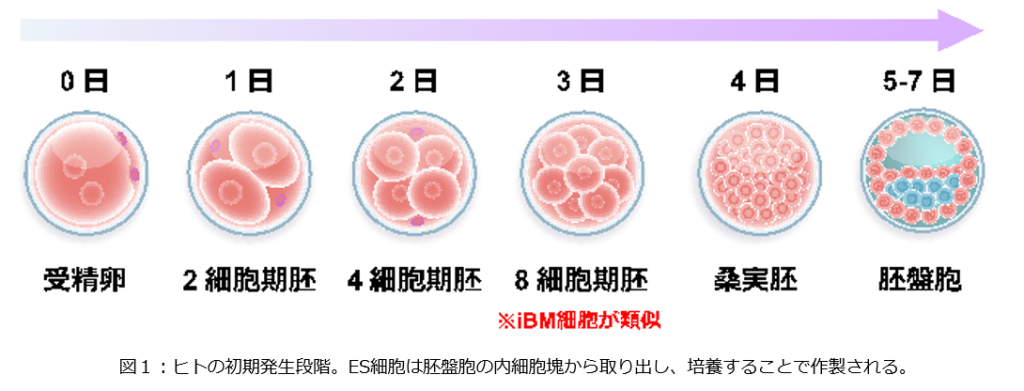
これらの細胞は誘導割球様 (induced blastomere-like: iBM) 細胞と名付けられました。iBM細胞は、新たに受精卵を作ることなく、胚性ゲノム活性化(embryonic genome activation: EGA)注3)の研究に役立つ細胞モデルとして用いることができるため、ヒトの初期発生の分子メカニズムの理解が加速することが期待されます(図1)。
本研究成果は、2022 年 6 月 30 日(米国時間)に、学術誌「Stem Cell Reports」でオンライン公開されました。
■ 研究の背景
生命は1つの受精卵から始まり、細胞分裂に伴い、細胞ごとに適切な遺伝子が適切な段階で活性化されて細胞が分化し、様々な組織や臓器が形成されます。受精直後の最初の遺伝子発現であるEGAは、あらゆる細胞に分化する能力の獲得・維持に非常に重要な段階です。EGAが適切に起こらないと、正常な発生が停止してしまうと考えられているため、EGAの詳細を明らかにすることで、不妊の原因究明や体外受精の成功率の向上に繋がることが期待されます。研究グループは以前、ヒト初期胚を用いて、一細胞レベルで網羅的に遺伝子の発現量を定量するシングルセルトランスクリプトーム解析により、数々のEGA遺伝子を同定しました。これらの遺伝子は分化能の獲得・維持に関与することが示唆され、再生医療研究への応用も期待されていますが、その多くは詳細な機能が分かっていません。
ヒトでは受精後2–3日で、4細胞期から8細胞期にかけてEGAが起こりますが、 EGAは動物種によって起こる時期が異なるため、動物モデルをヒトEGAの研究に使用するのは困難でした。また、多能性幹細胞であるES細胞・iPS細胞注4)は発生モデルとして広く用いられていますが、これらは受精後5日目以降の発生段階に相当し、EGAの研究モデルには適していません。従って、EGA遺伝子の機能を解明するには、ヒト初期胚そのものを使う必要があり、研究のために新たな受精卵を作り破壊することになるため、倫理的な問題を伴いました。
近年、研究グループは DUX4という転写因子注5)がEGA遺伝子の発現を促進することを報告しました。そこで、研究グループは、DUX4を用いてヒトES細胞のEGA遺伝子を活性化し、より受精卵に近い段階の細胞モデルを作製することを目指しました。
■研究の成果
DUX4はEGAに重要な役割を担う一方で、細胞毒性を持つことが知られています。顔面肩甲上腕型筋ジストロフィー(FSHD)注6)患者では、筋細胞に異所性に発現することで細胞死を引き起こします。実際、DUX4をヒトES細胞に長時間発現させると、数時間後には多くの細胞が死んでしまいました。これでは細胞モデルとして研究に使用することは出来ません。そこで、研究グループはヒト初期胚におけるDUX4の発現が一過性であることに着目し、15分間のみDUX4をES細胞に発現させることで、多くの細胞が生存し、増殖することを確認しました。短時間のDUX4発現では、DUX4が活性化するべきEGA遺伝子が十分に活性化されないことも懸念されましたが、長時間発現させた時と同等に活性化されていることが確認されました。
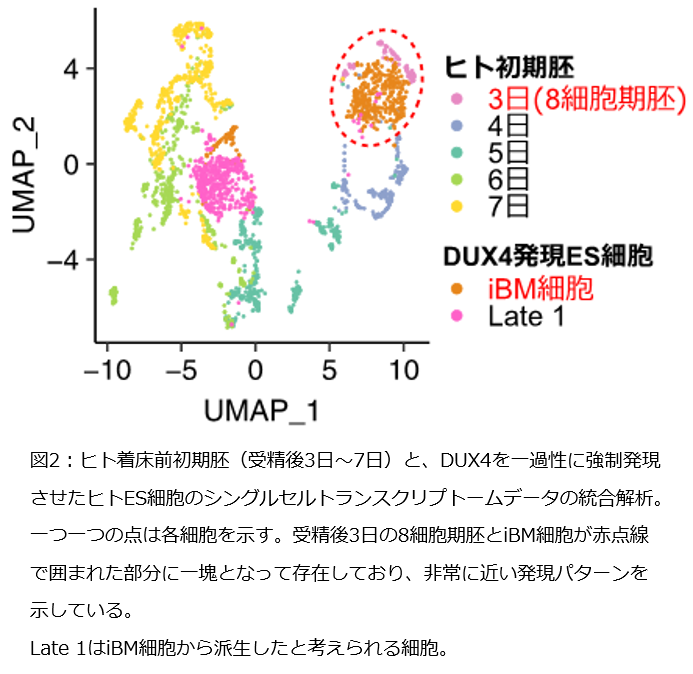
受精卵を含め、全ての細胞は同じ遺伝子情報を持っていますが、細胞種ごとに異なる遺伝子のセットが発現しています。特に初期発生段階では短期間で劇的に遺伝子の発現パターンが変化するため、発現パターンを調べることで、その細胞の発生段階を推測することができます。そこで、研究グループは、ヒト初期胚に発現している遺伝子を網羅的に解析したシングルセルトランスクリプトームのデータと、15分間のみDUX4を発現させたES細胞のシングルセルトランスクリプトームのデータを比較し、それらの類似性を確認しました。すると、DUX4を発現させたES細胞の一部の細胞集団が、受精後3日目の8細胞期胚に特異的に発現する遺伝子を多く発現し、8細胞期胚と類似した遺伝子発現パターンを示していました(図2)。これはつまり、ES細胞に特徴的な遺伝子の発現が減少し、8細胞期胚に特徴的な遺伝子の発現が増加したことで、元のES細胞の性質が失われ、8細胞期胚様の性質を獲得したと考えられます。研究グループは、これらの細胞をiBM細胞と名付けました。iBM細胞はDUX4を強制発現させてから12時間後の細胞に多く認められました。
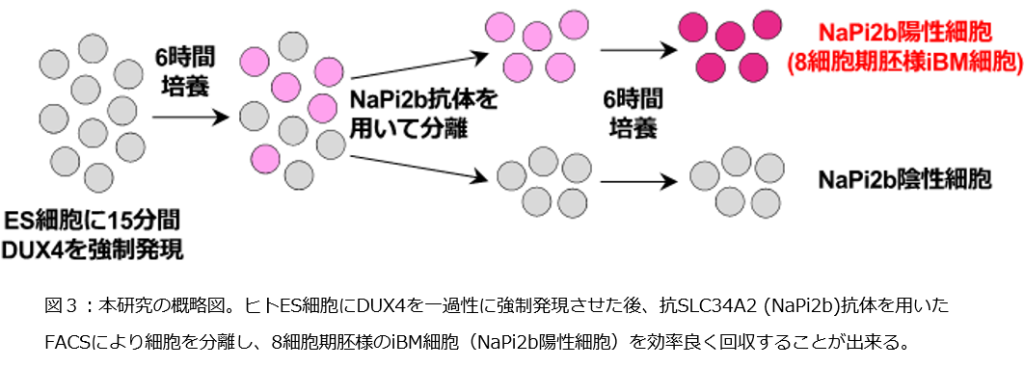
DUX4を強制発現したES細胞の一部のみが8細胞期胚に類似していたため、細胞モデルとして使用するには、これらの細胞を生きたままの状態で、効率良く回収する必要があります。FACS注7)は細胞表面に存在するタンパク質に対する抗体を用いて、様々な細胞から構成される集団から、特定の集団の細胞のみを生きたまま単離する技術です。研究グループはFACSによるiBM細胞の単離を目指し、DUX4を強制発現したES細胞の中で、iBM細胞に特異的に発現する細胞表面蛋白として、SLC34A2 (NaPi2b)を同定しました。DUX4強制発現後12時間でiBM細胞が多く認められたことから、強制発現後6時間後の細胞を抗NaPi2b抗体を用いたFACSにより分離し、さらに6時間培養しました。すると、NaPi2b陽性細胞は、NaPi2b陰性細胞やFACSによる分離前の細胞と比較し、8細胞期胚に近い遺伝子発現パターンを示していました。このことから、 抗NaPi2b抗体を用いて、効率良くiBM細胞を回収できることが分かりました(図3)。
■ 今後の展望
これまで適切なモデルが存在しなかったため、ヒトのEGA遺伝子の詳細な機能は長らく不明でしたが、本研究で作製されたiBM細胞にゲノム編集技術などを応用することで、これらの遺伝子の機能解明が可能となると考えられます。EGAは正常な胚発生が起こるための重要な鍵であり、EGAが適切に起こらないことで初期胚が死に至るとも考えられています。EGA遺伝子の機能解明により、ヒトの正常な初期発生過程のメカニズムを理解することで、不妊の原因究明や体外受精の成功率の向上などの生殖医療の発展だけでなく、分化能の獲得・維持機構の解明により再生医療研究の発展にも繋がることが期待されます。
■ 研究プロジェクトについて
本研究は、日本学術振興会 海外特別研究員制度、公益財団法人 アステラス病態代謝研究会、公益財団法人 日本アイバンク協会、スカンジナビア・ニッポン ササカワ財団からの支援を受けて実施されました。
■ 用語解説
注1)ES細胞:胚性幹細胞(embryonic stem cell)の略。受精後5-6日目の胚盤胞の内細胞塊から細胞を取り出し、それを培養することによって作製される。ほぼ無限に増殖させることができる。
注2)SLC34A2 (NaPi2b):IIb型ナトリウム依存性リン運搬蛋白 (NaPi2b)をコードする遺伝子。SLC34A2はII型肺胞上皮細胞に特異的に発現するとされているが、8細胞期胚にも高発現している。
注3)胚性ゲノム活性化 (EGA): Zygotic genome activation (ZGA)とも呼ばれる。受精時は母性因子に依存した遺伝子発現が見られるが、やがて母性因子は減少して胚自身からのゲノムの活性化へと切り替わる。これをEGAと呼ぶ。研究グループは以前、ヒト初期胚において32の遺伝子が4細胞期胚で、129の遺伝子が8細胞期胚で活性化されることを報告した。
注4)iPS細胞:人工多能性幹細胞(induced pluripotent stem cell)の略。体細胞に初期化因子を導入することにより樹立される多能性幹細胞。ES細胞に類似した性質を持つ。
注5)転写因子:DNA上の転写制御領域に結合することで、遺伝子の転写調節に関与するタンパク質。 京都大学の山中伸弥教授らにより発見された初期化因子も転写因子であり、ES細胞に多く発現する転写因子から絞り込まれた。
注6)顔面肩甲上腕型筋ジストロフィー:Facioscapulohumeral muscular dystrophy (FSHD)。顔面や肩、上腕などの筋肉の変性を起こす遺伝性疾患。本来発現していないDUX4が骨格筋細胞で発現し、細胞傷害を起こすと考えられている。
注7)FACS:Fluorescence-activated cell sortingの略。蛍光抗体で染色した細胞が発する蛍光を測定することで、特定の細胞を生きたままの状態で単離することができる。
■ 論文情報
タイトル:Transient DUX4 expression in human embryonic stem cells induces blastomere-like expression program that is marked by SLC34A2
著者:Masahito Yoshihara*,#, Ida Kirjanov*, Sonja Nykänen, Joonas Sokka, Jere Weltner, Karolina Lundin, Lisa Gawriyski, Eeva-Mari Jouhilahti, Markku Varjosalo, Mari H. Tervaniemi, Timo Otonkoski, Ras Trokovic, Shintaro Katayama, Sanna Vuoristo#, Juha Kere#
(*共同筆頭著者、#共同責任著者)
雑誌名:Stem Cell Reports









