■研究の概要
千葉大学大学院融合理工学府博士前期課程2年の山口諒氏、工学部4年 (当時) の山本哲晃氏、大学院工学研究院の河合 (野間) 繁子助教と、神奈川工科大学基礎・教養教育センターの神谷克政教授、早稲田大学理工学術院の梅野太輔教授らの共同研究チームは、微生物のDNAの転写を制御するタンパク質にシステイン注1)を導入することで、本来ヒ素注2)に全く反応しないタンパク質を、ヒ素に応答する新しいタンパク質に改変することに成功しました。本研究成果により、システインの導入によって様々なタンパク質を、環境中のヒ素汚染を感知するヒ素センサーに改変できることが期待されます。本技術が実現すれば、高度な機器が無い施設でも、安価な分析機器でヒ素の有無を検知することが可能になります。
この研究成果は、2024年3月27日 (日本時間) に米化学雑誌ACS Omegaに公開されました。また、本研究をイメージしたカバーアートが同雑誌の4月9日公開のトップページに掲載される予定です。
■研究の背景:
ヒ素は地球上どこにでも存在する毒性の高い元素で、微量でも長期間摂取することで皮膚疾患や神経疾患、がんなどの健康被害を発生するため、環境中のヒ素のモニタリングや検出は非常に重要です。これまではヒ素汚染を検出するのに高価な装置を使った化学分析が一般的でしたが、設備費用が高く、分析に専門性が必要という問題点がありました。近年、より安価で簡単にヒ素を検出できるシステムの構築を目指し、微生物が体内に持っているヒ素結合タンパク質を利用した微生物ヒ素センサーの開発が盛んに行われるようになりました注3)。
研究チームは、このヒ素結合タンパク質が3箇所のシステインにヒ素が結合し応答していることにヒントを得て、もともとヒ素に無反応なタンパク質でもシステインを3箇所導入すれば、ヒ素に応答するセンサータンパク質に作り変えることができ、さらにそのセンサータンパク質を大腸菌に導入すれば、従来のヒ素結合タンパク質だけでなくどんなタンパク質も微生物ヒ素センサーにできるのではないかと考えました。
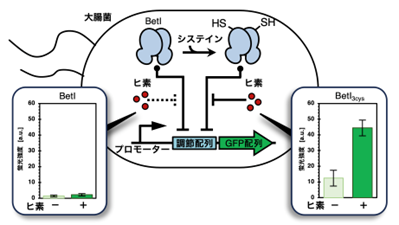
図中の-SHはBetIに導入したシステインのチオール基を表す。プロモーターとは下流の遺伝子(本研究ではGFP) の発現に重要なDNA配列。調節配列とは、転写制御因子 (本研究ではBetI) が結合し、下流の遺伝子の転写を制御するDNA配列
■研究の成果:
本研究では、システインを含まない大腸菌のコリン応答性転写抑制因子であるBetI注4)に、システインを人為的に導入することでヒ素応答性を付与し、転写抑制因子としての機能をヒ素でスイッチできる微生物ヒ素センサーシステムの構築を目指しました。BetIが下流の遺伝子の転写を抑制するために結合する調節配列の下流に緑色蛍光タンパク質 (GFP) をレポーターとして発現するように構築することで、大腸菌の一定細胞数あたりの蛍光強度を測定することによってヒ素の検出が可能となります。
まず、BetI タンパク質の予測構造をもとに、可動性が高くヒ素と結合しやすいループ構造に着目し、その中でもBetIの機能を阻害しない3箇所を選出し、それぞれのアミノ酸を1箇所から3箇所までシステインに置換した変異体シリーズを作製しました。
次に、それぞれのシステイン置換変異体を大腸菌に導入し、ヒ素を暴露しました。すると、3箇所全てをシステインに置換した変異体 (BetI3cys) は、ヒ素がないときに比べ、30%も高くヒ素に応答しました(図1)。興味深いことに、ヒ素応答性を獲得したBetI 変異体は、本来の機能であるコリンに対する応答性も保持していました。一方、システインに結合することが知られているヒ素以外の金属元素である銅と亜鉛には応答しませんでした。つまり、ヒ素に対する特異性の高いセンサータンパク質を誕生させることに成功したのです。
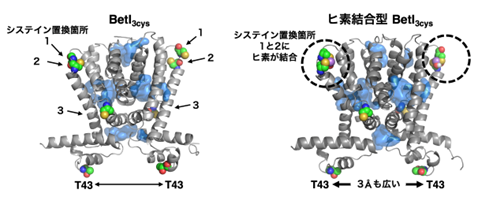
さらにBetI 変異体がヒ素応答性を示すメカニズムを分子動力学計算注5)によってシミュレーションすると、BetIの構造がヒ素の結合により大きく変化していることがわかりました。BetI の4番目のαヘリックス注6)と5番目のαヘリックスを繋いでいるヒンジ部分に導入した近接した2箇所のシステインに1分子のヒ素が結合することによって、4番目のαヘリックスが大きく湾曲しました。BetI は転写抑制因子として機能するときに常に同じ2つの分子がまとまった物質である「二量体」を形成しますが、その転写抑制機能に重要なDNAとの結合部位である43番目のスレオニン (T43)注7)の二量体間の距離が、3Å注8)も広がっていることがわかりました (図2)。この構造変化が、BetI3cysの調節配列からの乖離を促し、下流のGFPが発現しやすくなることで、結果としてヒ素応答性の付与につながったと考えています。
■今後の展望
本研究により、システインを導入することでヒ素と全く関連のないタンパク質にヒ素応答性を付与できることがわかりました。従来は、微生物を使ったヒ素センサーにはもっぱら既存のヒ素結合タンパク質が使われていましたが、この研究により、様々なタンパク質をセンサーとして利用できる可能性があることが明らかになりました。現段階ではまだ、既存のヒ素結合タンパク質にヒ素センサーとしての感度が劣りますが、微生物ヒ素センサーの研究分野に一石を投じることができ、今後のセンサー技術の革新につながることが期待できます。
■用語解説
注1)システイン:アミノ酸の一つ。側鎖にチオール基をもち、3価のヒ素と結合する。
注2)ヒ素:半金属としての性質があり、無機ヒ素は3価と5価の化合物をつくる。本研究では3価の亜ヒ酸を使用している。
注3)参考文献:Li, L., Environ. Sci. Technol.(2015); Sánchez, S., J. Electrochem. Soc.(2021)
注4) コリン応答性転写抑制因子BetI:BetIは大腸菌の浸透圧調節に関わるbetオペロンの発現を、DNA配列上の調節配列に結合することで抑制している。四級アンモニウムイオンのトリメチルアミノエタノールであるコリンが存在すると、BetIとコリンが結合することで、調節配列からBetIが乖離し、betオペロンの発現が亢進される。本研究ではbetオペロン配列を蛍光タンパク質GFPのDNA配列に置き換えている。
注5)分子動力学計算:計算科学を用いて分子の3次元構造や動きを推定する手法の一つ。古典力学のニュートンの運動方程式を応用し、短時間でシミュレーションすることができる。
注6)αヘリックス:タンパク質の二次構造の一つで、右巻きのらせん構造。
注7)スレオニン:アミノ酸の一つ。略号はTと表記する。
注8)Å (オングストローム):長さの単位。1オングストロームは0.1 ナノメートル。
■研究プロジェクトについて
本研究は、下記事業からの支援を受けて行われました。
- 一般財団法人 濱口生化学振興財団
- 科学研究費助成事業 (16H06450, 18H01791, 21H01721)
- 公益財団法人 双葉電子記念財団
- 公益財団法人 野田産業科学研究所
- ソルトサイエンス研究財団
■論文情報
タイトル:Imparting As(III) responsiveness to the choline response transcriptional regulator BetI
著者:山口諒, 山本哲晃, 梅野太輔, 神谷克政, 河合(野間)繁子
雑誌名:ACS Omega
DOI:https://doi.org/10.1021/acsomega.3c09604








