千葉大学大学院薬学研究院高倉勇気特任研究員、高野博之教授、山口憲孝准教授のグループは、理化学研究所生命医科学研究センター秋山泰身チームリーダーらとの共同研究により、免疫における最大の謎の一つである、免疫による自己組織への攻撃(自己免疫疾患注1))を防ぐしくみを解明しました。
自己免疫疾患の抑制に深く関わる胸腺オートファジーの分子メカニズム解析により、ミトコンドリアに局在する小さなタンパク質(Chromosome 15 Open Reading Frame 48: C15ORF48)が胸腺オートファジーの重要な誘導分子であることを世界で初めて明らかにしました。この成果は、膠原病などの自己免疫疾患の発症機構の解明や予防・治療法開発に役立つと期待されます。
本研究成果は、2024年2月1日(現地時間)に英国科学雑誌Nature Communicationsにオンライン掲載されました。
■研究の背景
免疫は、細菌やウイルスなどの外部からの異物を攻撃して生体を守るしくみですが、免疫の調節機構に異常が生じると自己免疫疾患を発症します。
免疫において中心的な役割を果たす細胞はTリンパ球です。Tリンパ球は細胞ごとに異なるセンサー(T細胞受容体)を表面にもち、センサーが異物を認識するとTリンパ球は活性化し異物を攻撃します。このセンサーが自己組織を認識した場合は、自己組織を攻撃する自己反応性Tリンパ球となり自己免疫疾患の原因となります。
通常、生体内では、胸部にある胸腺という組織に存在する胸腺髄質上皮細胞(medullary Thymic Epithelial Cell: mTEC)によって自己反応性Tリンパ球になる可能性が高い未熟なTリンパ球が選別・除去されています(図1)。
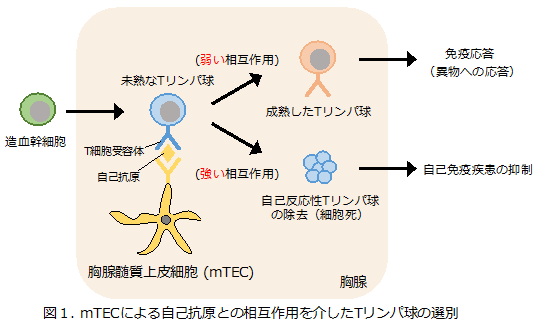
このmTECが自己反応性Tリンパ球を除去する機構において重要な役割をもつのがオートファジーです。オートファジーは、細胞が栄養飢餓にさらされた際に誘導され細胞内タンパク質を分解して栄養源としての再利用を促す現象として広く知られていますが、mTECにおけるオートファジー(胸腺オートファジー注2))は栄養飢餓と無関係に恒常的に誘導される特殊なオートファジーであることがわかっています。自己免疫疾患の抑制に重要な現象ですが、その分子メカニズムは解明されていませんでした(図2)。
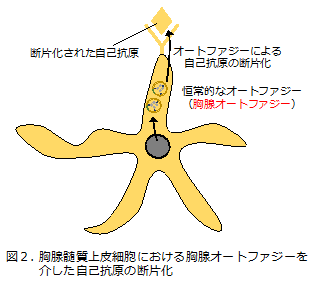
そこで研究グループは、胸腺オートファジー誘導メカニズムを解明するため、遺伝子発現データベースの解析を駆使してmTECにおいて高く発現する遺伝子を抽出し、その中からmTECの分化・成熟に重要なシグナル伝達系に関連するものを選別した結果、これまでオートファジーとの関連は報告されていなかったC15ORF48注3)をオートファジー誘導遺伝子として見出しました。
■研究成果
研究グループは、このC15ORF48と栄養飢餓との関連について解析し、C15ORF48の過剰発現では栄養飢餓応答が誘導されないことを見出しました。このことから、C15ORF48は栄養飢餓に依存せずオートファジーを活性化することがわかりました。
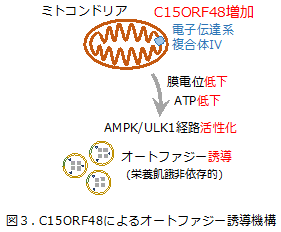
次に、C15ORF48によるオートファジー誘導メカニズムを解析するためにミトコンドリアへの影響分析を行い、C15ORF48発現によりミトコンドリア膜電位が低下すること、また、ミトコンドリア膜電位に依存して合成される物質であるATPも低下することを見出しました。ATPが低下すると、オートファジーを誘導するシグナル伝達系であるAMPK-ULK1経路を活性化することが知られています。これらのことから、C15ORF48はミトコンドリア膜電位を抑制し、ATP合成低下によるAMPK-ULK1経路活性化を介してオートファジーを誘導することが明らかとなりました(図3)。
次に、独自に作製したC15ORF48欠損マウス(以下、欠損マウス)を用いたオートファジー活性評価により、正常マウスでは恒常的に誘導される胸腺オートファジーが欠損マウスでは顕著に低下していることがわかりました。比較のためにマウスを二日間絶食させて筋組織に誘導される栄養飢餓依存的オートファジーとの関連を検討したところ、欠損マウスでは正常マウスと同レベルのオートファジーが誘導されることがわかりました。これらのことから、C15ORF48は栄養飢餓依存的な通常のオートファジーには関与せず胸腺オートファジーに特異的に作用するタンパク質であることが判明しました。
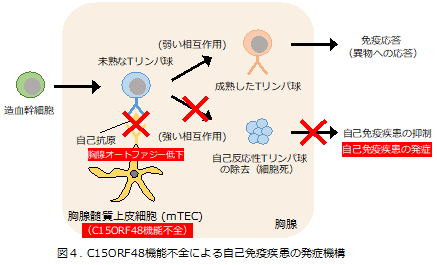
最後に、欠損マウスの自己免疫疾患の症状について解析したところ、以下の3点がわかりました。①涙腺や顎下腺などに対する自己抗体の増加。②肺や肝臓などにおける免疫細胞の浸潤性の増加による炎症反応の誘導。③糸球体への自己抗体の蓄積。これらのことから、欠損マウスは自己免疫疾患を呈することが明らかとなりました。
以上の結果より、C15ORF48はミトコンドリア膜電位とATPの低下によるAMPK-ULK1経路の活性化を介して胸腺オートファジーを誘導し、自己免疫疾患を防ぐ役割をもつことがわかりました(図4)。
■今後の展望
本研究から、胸腺オートファジーの誘導因子としてC15ORF48が同定され、C15ORF48の機能不全が胸腺オートファジーとmTECにおける自己反応性Tリンパ球除去の低下を招き自己免疫疾患の原因となることが初めて明らかとなりました。今後、膠原病などの自己免疫疾患とC15ORF48との関連性を解析するとともに、C15ORF48に着目した新たな治療薬の開発を進める計画です。
■資金情報
本研究の一部は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「構造的・動力学的制約を活用した多元混合化学情報の解読とその応用」の支援を受けて行われました。
■論文情報
タイトル: Mitochondrial protein C15ORF48 is a stress-independent inducer of autophagy that regulates oxidative stress and autoimmunity
著者: Yuki Takakura, Moeka Machida, Natsumi Terada, Yuka Katsumi, Seika Kawamura, Kenta Horie, Maki Miyauchi, Tatsuya Ishikawa, Nobuko Akiyama, Takao Seki, Takahisa Miyao, Mio Hayama, Rin Endo, Hiroto Ishii, Yuya Maruyama, Naho Hagiwara, Tetsuya J. Kobayashi, Naoto Yamaguchi, Hiroyuki Takano, Taishin Akiyama, and Noritaka Yamaguchi.
雑誌名: Nature Communications
DOI: 10.1038/s41467-024-45206-1.
出版日:2024年2月1日
■用語解説
注1)自己免疫疾患:免疫系が正常に機能しなくなり、自分自身の正常な細胞や組織に対して過剰に反応し攻撃してしまう疾患の総称。シェーグレン症候群、全身性エリトマト―デス、関節リウマチなどの膠原病や心筋炎、肝炎、腎炎などが含まれる。
注2)胸腺オートファジー:胸腺髄質上皮細胞(mTEC)において恒常的に誘導されるオートファジー。mTECにおいて発現した自己抗原の断片化に関与する。断片化された自己抗原は、未熟なTリンパ球に提示されmTECによる自己反応性Tリンパ球の選別・除去に利用される。
注3)C15ORF48:ミトコンドリアに局在する83アミノ酸からなる小さなタンパク質。電子伝達系複合体IVの構成因子と考えられている。








