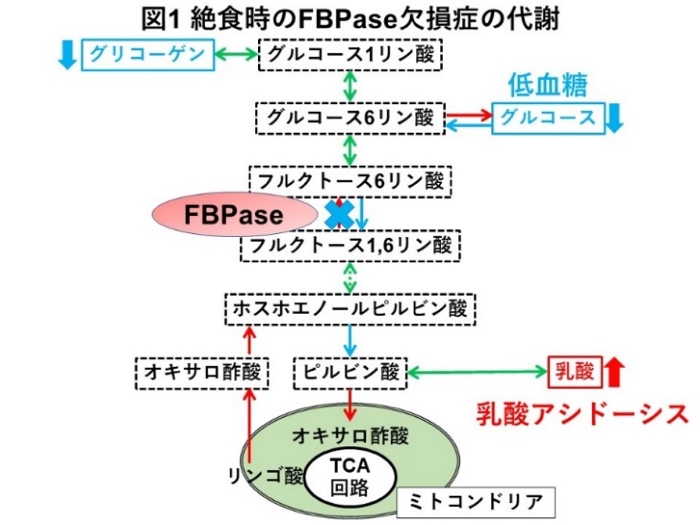
FBPase欠損症は、糖新生の障害を伴う先天代謝異常症で、体内で糖を合成するのに重要である酵素「肝型FBPase」の欠損により生じます。普段は無症状ですが、長時間の絶食によりグリコーゲンが枯渇すると低血糖をきたし、糖新生の基質である乳酸が蓄積して重篤な低血糖と乳酸アシドーシス注3)を引き起こします(図1)。FBPase欠損症は1970年、低血糖および乳酸アシドーシスをきたす疾患として初めて報告され、1997年、同疾患においてFBPaseをコードするFBP1遺伝子の変異が生じていることが報告されました。以降、複数のFBP1遺伝子変異が報告されていますが、FBPase欠損症は非常に稀な疾患のため、FBP1遺伝子変異による発症メカニズムの解析は十分にされていません。
■研究の背景と経緯
FBPase欠損症は、糖新生の障害を伴う先天代謝異常症で、体内で糖を合成するのに重要である酵素「肝型FBPase」の欠損により生じます。普段は無症状ですが、長時間の絶食によりグリコーゲンが枯渇すると低血糖をきたし、糖新生の基質である乳酸が蓄積して重篤な低血糖と乳酸アシドーシス注3)を引き起こします(図1)。FBPase欠損症は1970年、低血糖および乳酸アシドーシスをきたす疾患として初めて報告され、1997年、同疾患においてFBPaseをコードするFBP1遺伝子の変異が生じていることが報告されました。以降、複数のFBP1遺伝子変異が報告されていますが、FBPase欠損症は非常に稀な疾患のため、FBP1遺伝子変異による発症メカニズムの解析は十分にされていません。
■研究の内容
本研究では、FBPase欠損症患者においてFBP1遺伝子のミスセンス変異注4)を同定しました。そして、今回同定した変異(G164D, F194S)に加えて、過去にFBPase欠損症で報告されているFBP1ミスセンス変異の機能解析を行い、FBP1変異の生化学的特性に基づき、Type1とType2に分類を行いました(図2)。
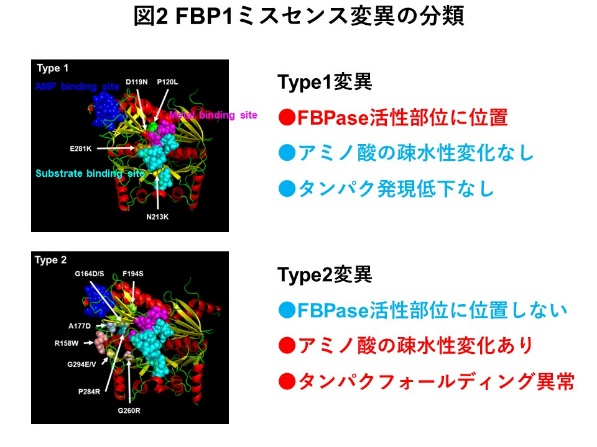
Type1変異(D119N, P120L, N213K, E281K)は、FBPase活性部位に位置しており、FBPase活性低下をきたしますが、FBP1タンパクの発現は保たれます。一方、Type2変異(R158W, G164D, G164S, A177D, F194S, G260R, P284R, G294E, G294V)は、FBPase活性部位に位置しませんが、アミノ酸の疎水性に変化を認め、タンパクフォールディング異常を引き起こし、FBP1タンパクの発現低下とFBPase活性欠損を生じます。
■今後の展開
Type2変異は、タンパクのフォールディング異常を介して、FBP1タンパクの発現低下を引き起こし、FBPase活性欠損症に結びつくことを明らかにしました。本研究の成果は、シャペロン療法注5)がType2変異に対する新たな治療選択となる可能性を示しており、今後、FBP1遺伝子の変異箇所に応じたFBPase欠損症の有効な治療法の開発につながることが期待できます。
■用語解説
注1)FBPase欠損症:フルクトース-1,6-ビスフォスファターゼ(FBPase)は、糖新生において、フルクトース-1,6-二リン酸からフルクトース-6-リン酸への変換を行う酵素である。FBPase欠損症は、常染色体劣性遺伝形式をとり、長期絶食時に低血糖、乳酸アシドーシスをきたす。
注2)タンパクフォールディング異常:細胞内のタンパク質は、正しい立体構造を形成(フォールディング)することで、独自の機能を発揮する。一方、タンパク質が誤った立体構造(フォールディング異常)をとった場合、分解除去される。
注3)乳酸アシドーシス:乳酸が体内に蓄積することで、血液が酸性に傾いた状態(アシドーシス)。
注4)ミスセンス変異:遺伝子のDNA配列の1塩基対が変化することで、その遺伝子からつくられるアミノ酸のうち1つが別のアミノ酸に置換される変異をミスセンス変異という。
注5)シャペロン療法:ある蛋白質の機能発現に必要な過程を手助けする介添役のタンパク質を分子シャペロンである。不安定な変異タンパク質の形状を分子シャペロン薬で構造を保持し、正常に機能させる治療方法をシャペロン療法と呼ぶ。現在ファブリー病に対するシャペロン療法が2018年に承認され、新たな治療手段として期待されている。
■研究プロジェクトについて
本研究は、以下の支援を受けて遂行されました。
・日本学術振興会・科学研究費補助金挑戦的研究(B)ミトコンドリア複合体と制御メカニズム解析から捉える肥満・糖尿病の分子病態研究(研究代表者:田中知明)2019年度~2022年度
・日本学術振興会・科学研究費補助金基盤研究(C)非アルコール性脂肪肝と肝糖代謝制御を標的としたFDXRによる鉄代謝調節機構の役割(研究代表者:佐久間一基)2021年度~2023年度
■論文情報
タイトル:Identification of genotype–biochemical phenotype correlations associated with fructose1,6-bisphosphatase deficiency
著者:Ikki Sakuma, Hidekazu Nagano, Naoko Hashimoto, Masanori Fujimoto, Akitoshi Nakayama, Takahiro Fuchigami, Yuki Taki, Tatsuma Matsuda, Hiroyuki Akamine, Satomi Kono, Takashi Kono, Masataka Yokoyama, Motoi Nishimura, Koutaro Yokote, Tatsuki Ogasawara, Yoichi Fujii, Seishi Ogawa, Eunyoung Lee, Takashi Miki & Tomoaki Tanaka
雑誌名:Communications Biology
DOI:https://doi.org/10.1038/s42003-023-05160-y









