■研究の概要
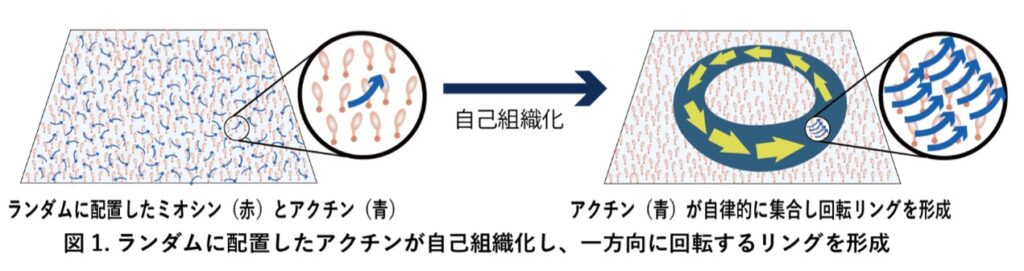
千葉大学大学院理学研究院の原口武士助教、伊藤光二教授、京都大学大学院工学研究科の井上康博教授、九州大学先導物質化学研究所の森俊文准教授、大阪大学大学院理学研究科の松野健治教授らの研究グループは、細胞内のタンパク質が、特別な設計図や指令がなくても、自ら秩序だった構造を作り出す仕組みを明らかにしました。またその仕組みとして、分子モーター (ミオシンCcXI)注1)とアクチン注2)という2種類のタンパク質の相互作用だけで、アクチンが自律的に集まり、一方向に回転し続けるリング状の秩序構造が自律的に形成されることを示しました (図1、および巻末の二次元コードより顕微鏡動画を視聴可能)。これは、細胞内に見られる秩序やキラリティ(左右非対称性)が、ある種の分子モーターの働きを起点として、自然に生じ得ることを示しています。本研究により、生命の形や左右非対称性がどのように作られるのかという根源的な問いに答えるだけでなく、自律的に動くバイオマテリアルの設計など、医療、エネルギー、電子機器の分野において重要なナノテクノロジーへの応用も期待されます。
本研究成果は、2026年1月28日(日本時間1月29日)に米国科学誌Proceedings of the National Academy of Sciences of the United States of America (PNAS)で公開されました。
■研究の背景
細胞の内部では、アクチン繊維などのタンパク質が秩序だった配置をとり、細胞の形や運動、物質輸送を支えています。また、動物では臓器配置や細胞運動において左右非対称性(キラリティ)が普遍的に見られます。このような「細胞内秩序」や「左右非対称性」は、生命の形と機能を決定づける根幹的な性質ですが、それらがどのように生み出されるのかは長年の未解決問題でした。外部からあらかじめ秩序立った型や指令が与えられているとは考えにくく、細胞内のタンパク質同士の相互作用によって秩序が自発的に生じる「自己組織化」が重要であると考えられてきました。しかし、その分子レベルの原理はほとんど明らかになっていませんでした。
近年、ショウジョウバエのミオシンIDなど一部の分子モーターがアクチン繊維を一方向に曲げながら動かすという特異な性質をもつことが報告され参考文献1)、細胞内秩序やキラリティ形成との関係が注目されてきました。しかし、このような分子レベルの特性が、どのようにして細胞スケールの秩序構造へとつながるのか、その因果関係は依然として不明でした。
■研究の成果
本研究では、細胞の外で再構成した実験系(in vitro)において、シャジクモ由来の分子モーター「ミオシンCcXI」を用い、その動態を解析しました 。このミオシンは、アクチン繊維を一方向に曲げながら動かすという特異な性質を持っています。実験の結果、ランダムに配置されたアクチン繊維が、このミオシンの働きのみによって、外部から指示を与えなくても、自発的に秩序立った構造を作り出すことを明らかにしました(図1)。形成されたリング状構造は、細胞サイズで安定して回転を続ける秩序構造であり、分子レベルの運動特性が、細胞スケールの秩序と左右非対称性へと直接つながることを示した初めての例です。さらに、研究グループは、繊維の先端で発生する「曲がる力」と、繊維同士の「整列」というルールに基づいたシミュレーションを実施しました。その結果、実験で観察されたものと同様の回転リングが再現され、「分子レベルの曲がる個性」と「集団としての相互作用」が組み合わさることで、安定した回転構造が生まれるというメカニズムを理論的にも証明しました。
本研究成果は、植物細胞におけるアクチン繊維の極性配向注3) や、動物細胞における左右非対称性が、分子モーターに駆動された自己組織化によって生じ得ることを示す「最小モデル」と位置づけることができ、細胞や個体の形がどのように作られるのかという根源的な問いに対して、明確な分子レベルの説明を与えるものです。 本研究で in vitro により形成されたリング状構造は、植物細胞内で観察される、アクチン繊維が一定方向に極性をそろえて配向した構造とよく似た特徴を示しています(図2)。
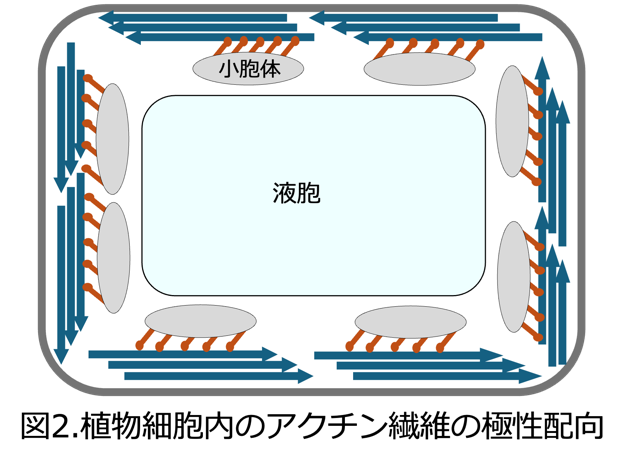
このことは、本研究で明らかにした自己組織化過程が、単純化した再構成系においても成立する基本原理であると同時に、実際の細胞内で見られるアクチン配向の形成原理を捉えていることを示唆しています。
■今後の展望
本研究で明らかになった自己組織化原理は、細胞内秩序や左右非対称性がどのように生み出されるのかを理解するための基本原理として、幅広い分野への波及が期待されます。例えば、植物細胞における細胞成長や物質輸送の制御原理の理解を通じて、植物の成長制御や生産性向上に資する基礎的知見を提供する可能性があります。また、分子レベルの運動特性からマクロな秩序構造が自律的に形成される仕組みは、自律的に秩序や運動を生み出す新しいタンパク質工学やバイオマテリアル設計の指針としても活用が期待されます。
本研究は、生命現象に見られる秩序形成を「結果」ではなく、理解可能な設計原理として捉える道を拓くものです。分子から細胞、さらに人工システムへと広がる秩序形成の理解に、新たな基盤を提供することが期待されます。
■用語解説
注1)分子モーター (ミオシンCcXI):ATP加水分解のエネルギーを使って運動するタンパク質。並進運動するモータータンパク質としてミオシン、ダイニン、キネシン、回転運動するモータータンパク質としてF型ATPase, V型ATPaseなどがある。このうち、アクチン上を運動するタンパク質をミオシンと呼ぶ。ミオシンCcXIは、高速運動するミオシンとして知られており、生物界で最速のミオシンであるミオシンCbXI-1参考文献2)のパラログである。
注2)アクチン:細胞骨格を構成する主要なタンパク質の一つ。重合してアクチン繊維を形成し、分子モーターと相互作用することで、細胞内の構造形成や運動に関与する。
注3)極性配向:アクチン繊維が持つ「プラス端」と「マイナス端」という方向性(極性)が、一定の向きに揃って配置されること 。ミオシンは決まった方向(多くの場合はプラス端側)へ動くため、極性が揃うことで細胞内の大規模な物質輸送(原形質流動)が可能になる 。本研究は、外部からの指令がなくても、分子モーターの働きによってこの秩序だった配向が自律的に形成される仕組みを明らかにした。
■研究プロジェクトについて
本研究は、JP 25H01811, JP 24K09482, JP 22K20623(原口武士), JSPS科研費JP 22H04833, JP 23K05710, JP 20K06583, JP 17K07436, JP 15H01309(伊藤光二), JP 24K21756, JP 23K23303, JP 23KK0254 (森俊文)、JP 24H01284, JP 15H05863(松野健治)の助成を受けたものです。
■論文情報
タイトル:Elucidating chiral myosin-induced actin dynamics: From single-filament behavior to collective structures
著者:Takeshi Haraguchi, Kohei Yoshimura, Yasuhiro Inoue, Takuma Imi, Koyo Hasegawa, Taisei Nagai, Hideki Furusawa, Toshifumi Mori, Kenji Matsuno, and Kohji Ito
雑誌名:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
DOI:10.1073/pnas.2508686123
■関連動画:本研究で観察されたアクチン繊維の自律的な回転運動(顕微鏡動画)を以下のURLもしくは二次元コードより、ご覧いただけます。
動画URL:https://www.youtube.com/watch?v=y5vGEL7MtM0

■参考文献1
タイトル:Molecular to organismal chirality is induced by the conserved myosin 1D
雑誌名:Science
DOI:10.1126/science.aat8642
■参考文献2
2022年2月21日公開プレスリリース「生物界で最速のミオシンの発見とその構造解析に成功」













